|
|
||
|
|
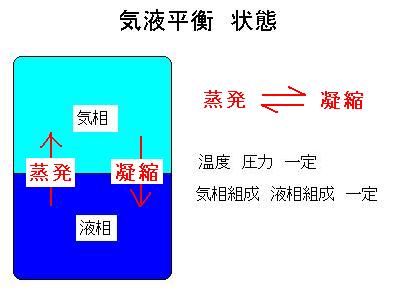
密閉した容器中に溶液を入れた状態で、温度、圧力、気相と液相の各組成が変わらない状態を気液平衡と言います。図を参照してください. これは液相から気相への蒸発と気相から液相への凝縮とが平衡になった状態です.蒸発・凝縮の際,通常の気液平衡では成分同士は反応しません.反応をする場合は「反応を伴う気液平衡」と言って区別します.揮発成分同士の気液間の平衡を気液平衡と言い,固体成分を含む平衡(蒸気圧降下や沸点上昇)は気液平衡とは言わずに固液平衡と言います. 温度、圧力、気相と液相間の関係を図で示すのが気液平衡曲線あるいは相図と言います.また気相と液相間の関係を図で示すのがx-y曲線で,主に化学工学で使います.参考:気液平衡データ |
|
 |
||
|
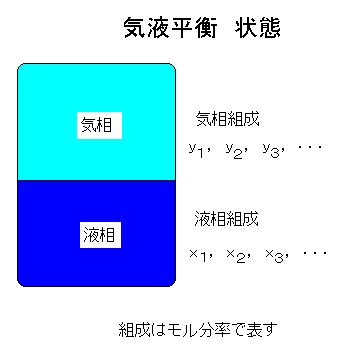
気液平衡の表現方法は種々あり、大別すると次の5種になります。 |
||
|
||
 |
||
|
y2=K2x2 y3=K3x3 ..... yn=Knxn ここに, K1,K2,K3,....Knを平衡係数あるいは平衡比と言います。1,2,3,....,nはそれぞれ第1成分,第1成分,第2成分,第3成分,,..,第n成分を示します。 |
||
|
||
|
y2=α2x2/(α1x1+α2x2+α3x3+...+αnxn) y3=α3x3/(α1x1+α2x2+α3x3+...+αnxn) ..... ここに, α1,α2,α3,....を相対揮発度と言い、 それぞれ,P1/Pn,P2/Pn,P3/Pn,....,Pn/Pnであり、P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。 |
||
|
||
 |
||
|
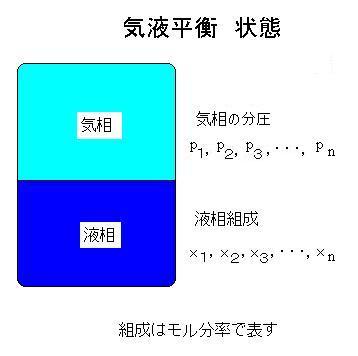
ラウールの法則による表現 p2=P2x2 p3=P3x3 ..... pn=Pnxn ここに, p1,p2,p3,....,pnを各成分の分圧と言います。 P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。このように気液平衡を表現できるのは理想溶液の場合です。蒸気圧はアントワン式により計算します. |
||
|
||
|
p1=P1γ1x1 p2=P2γ2x2 p3=P3γ3x3 ..... pn=Pnγnxn ここに,P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧である。p1,p2,p3,....,pnを各成分の分圧と言います。γ1,γ2,γ3,....,γnをそれぞれ各成分の活量係数と言い、非理想溶液の気液平衡を表現するための熱力学的に定義される係数です。ラウールの法則を活量係数で補正した表現です.活量係数はウィルソン式により計算します. |
||
|
||
|
成分の1つが臨界温度を超える温度ではラウールの法則などでは表現できません.このような場合は状態方程式を使います. |
||
|
気液平衡計算法の詳しい解説は大江修造 「物性推算法」 |
||
無断転載不可 © 大江 修造, 2012